腫瘤的發生發展不僅取決于基因的突變或缺失,還隨著腫瘤細胞的代謝重塑或異常改變而發生改變。在營養缺乏的條件下,腫瘤細胞的代謝重編程賦予癌細胞快速增殖的能力。其中,氨基酸代謝重編程是腫瘤代謝異常改變的重要特征之一。研究發現,氨基酸不僅能夠作為氮供體為腫瘤細胞的增殖、侵襲和免疫逃逸過程提供核苷酸等生物大分子的合成原料,而且還是腫瘤微環境中免疫細胞活化和發揮抗腫瘤作用的重要代謝物質。氨基酸代謝的異常改變與腫瘤的發生發展和腫瘤免疫密切相關,其代謝途徑中的部分關鍵蛋白質或關鍵酶可作為腫瘤診斷和治療的生物標志物。因此,本文圍繞氨基酸轉運體對癌細胞增殖的影響和腫瘤代謝循環過程中的谷氨酰胺、天冬酰胺、絲氨酸和甘氨酸等氨基酸代謝的異常改變進行總結,介紹了氨基酸代謝與腫瘤細胞mTOR 信號通路、腫瘤微環境和免疫細胞功能的相關性,對靶向氨基酸代謝的腫瘤治療藥物進行了分析和展望。期望該工作為深入了解氨基酸代謝對腫瘤發生發展的調控及其可能存在的腫瘤治療靶點提供有用的參考。
上個世紀30 年代末,研究人員首次發現腫瘤細胞具有瓦博格效應(Warburg effect)。該發現不僅引領了從代謝的角度研究腫瘤發生發展的新方向[1]
,還揭示了腫瘤細胞內部的葡萄糖代謝重編程現象。隨著對腫瘤代謝逐步深入的研究,發現腫瘤細胞為滿足其增殖所需的能量要求,通常出現能量和物質代謝重編程的現象[2] 。然而,值得注意的是,某些腫瘤細胞在增殖或轉移過程中存在不依賴葡萄糖而更依賴谷氨酰胺的情況[3] 。研究表明,除了糖代謝能夠為腫瘤細胞增殖提供能量外,氨基酸代謝也在腫瘤的發生發展過程中具有不可替代的作用。
在腫瘤的發生發展過程中,癌細胞內氨基酸的攝取速率、氨基酸的代謝途徑、代謝產物或代謝關鍵酶出現異常的現象稱之為氨基酸代謝重編程。其中,腫瘤細胞內的氨基酸除了直接參與蛋白質合成外,還通過分解代謝產物與其他對腫瘤發生至關重要的代謝途徑相關聯。在許多人類癌癥中,均發現氨基酸代謝重編程與腫瘤發展具有相關性,包括卵巢癌、肝細胞癌、腎透明細胞癌和乳腺癌等[4-8] 。另外,研究發現,精氨酸、色氨酸等對于T 細胞的活化和分化具有重要功能[9] ;同樣,腫瘤微環境(tumormicro-environment, TME)中的某些氨基酸的缺乏或氨基酸代謝物的產生,對于免疫細胞的功能維持也很重要。這表明,氨基酸不僅在腫瘤細胞增殖過程中能夠提供能量,還能通過調控免疫細胞功能間接參與腫瘤免疫過程。因此,了解腫瘤的氨基酸代謝重編程及其參與腫瘤免疫的機制,對于研究腫瘤異常代謝的發生發展及尋找腫瘤的治療靶點具有重要指導意義。
1 與腫瘤代謝相關的氨基酸轉運體
腫瘤細胞在增殖過程中,為滿足其能量需求,需要大量攝取氨基酸,但是由于氨基酸具有親水性,不能以自由擴散的形式被腫瘤細胞攝取和利用,因此,需要各種氨基酸轉運體的協助。這意味著腫瘤細胞的增殖與氨基酸轉運體的表達密切相關。為滿足癌細胞攝取氨基酸的需求,氨基酸轉運體(heteromericamino acid transports, HATs)能夠轉運腫瘤細胞所需的多種必需氨基酸,并參與調控腫瘤細胞攝取氨基酸的速率和維持胞內氨基酸的水平[10] 。而且有研究發現,多種氨基酸轉運體能夠促進癌細胞中雷帕霉素靶蛋白( mammalian target of rapamycin,mTOR)的活化和腫瘤細胞增殖。因此,氨基酸轉運體對于腫瘤細胞的發生發展具有調控功能,通過靶向氨基酸轉運體實現對腫瘤生長的抑制是一個有效的策略[11] 。
1. 1 谷氨酰胺轉運體
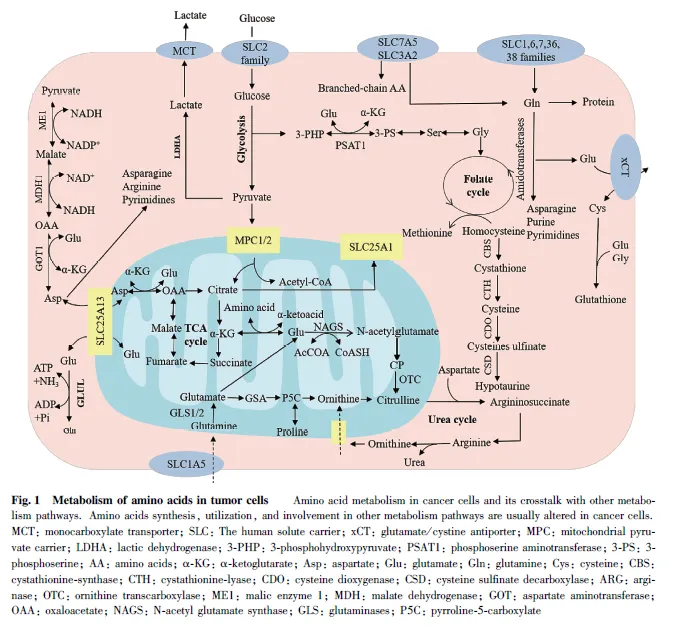
在正常細胞內,丙氨酸,絲氨酸,半胱氨酸轉運蛋白2 ( alanine, serine, cysteine transporter 2,ASCT2)屬于溶質載體家族1 (solute carrier family1, SLC1)成員,負責谷氨酰胺和天冬酰胺的轉運。然而,研究發現,ASCT2 在多種類型的癌細胞中表達量上調,并幫助腫瘤細胞攝取更多的谷氨酰胺用于增殖[12] 。而腫瘤細胞的快速增殖又進一步促進了ASCT2 的表達,由此形成了腫瘤細胞異常增殖的惡性循環。在多種異種移植模型中發現, 敲低ASCT2 會降低mTORC1 的活性并抑制腫瘤的生長[13] 。除此之外,鈉離子依賴的中性氨基酸轉運蛋白2(sodium-dependent neutral amino acid transporter2, SNAT2)也是谷氨酰胺的轉運體之一,然而,值得注意的是,谷氨酰胺主要通過ASCT2 轉運進入癌細胞[14] ,當腫瘤中ASCT2 缺失時,細胞會上調SNAT2的表達從而替代ASCT2 的功能。若同時缺失ASCT2 和SNAT2 則會減緩腫瘤細胞的生長[15] 。研究表明,SNAT2 對于腫瘤細胞的增殖同樣具有調控作用。
1. 2 必需氨基酸轉運體
必需氨基酸對于癌細胞的增殖是必不可少的,它們通過細胞膜的攝取受到膜轉運蛋白質的嚴格控制,因此,必需氨基酸轉運體對調控腫瘤細胞的增殖具有重要作用。其中,L-型氨基酸轉運蛋白1(Ltypeamino acid transporter 1, LAT1)能轉運腫瘤細胞所需的中性氨基酸。在許多類型的癌癥中都發現LAT1 高表達,且LAT1 上調可導致人類腫瘤細胞功能異常[16] 。研究發現,在結直腸癌細胞中,由于基因的突變會導致谷氨酰胺的攝取增多,從而改變了細胞的代謝。在此過程中,LAT1 會在特異性基因激活后維持細胞氨基酸水平。因此,其對早期和晚期轉移性疾病模型中的結直腸腫瘤發生至關重要[17] 。并且LAT1 是調節腫瘤血管內皮生成和腫瘤增殖的關鍵分子[18] ,抑制LAT1 可導致某些類型的癌癥發生細胞凋亡。例如,T 細胞急性淋巴細胞白血病、膽管癌和骨肉瘤等[19-21] 。其他研究也表明,在人類巨噬細胞、B 細胞和自然殺傷細胞中,敲除LAT1 或抑制其活性會降低亮氨酸攝取、mTOR 復合物1(mTOR complex 1, mTORC1)活性、糖酵解速率和c-Myc 水平,并且進一步降低白介素-1β(Interleukin-1β, IL-1β)的產生[22-23] 。研究表明,LAT1不僅與腫瘤細胞內的信號通路相互作用參與腫瘤細胞增殖調控,還通過調節免疫細胞生長或細胞因子的產生,參與腫瘤免疫過程。
1. 3 胱氨酸/ 谷氨酸反向轉運蛋白
胱氨酸/ 谷氨酸反向轉運蛋白(system Xc-)是氨基酸轉運蛋白質家族的成員,由輕鏈xCT 和重鏈4F2hc 這2 個亞基組成。在正常細胞中,溶質載體家族7 成員11(solute carrier family 7 member 11,SLC7A11)屬于胱氨酸/ 谷氨酸逆向轉運蛋白,其能將氧化的半胱氨酸轉運至細胞,并將胞內產生的谷氨酸排出細胞[24] (見Fig. 1)。SLC7A11 能夠通過促進谷胱甘肽的生物合成,來降低氧化應激反應,從而參與細胞增殖調控。腫瘤細胞由于代謝途徑的異常,對抗氧化機制具有很強的依賴性,已有研究表明,阻斷SLC7A11/ 谷胱甘肽軸選擇性地抑制鼠類肉瘤病毒癌基因(kirsten rat sarcoma viral oncogene,Kras)突變的非小細胞肺癌的生長[25-26] 。因此,谷胱甘肽的平衡和抗氧化能力的增強對于腫瘤細胞的增殖具有重要意義。有研究證實,xCT 在多種類型的腫瘤中出現高表達,并與腫瘤增殖、侵襲、轉移和耐藥性有關[27] ,并且ASCT2 和xCT 在氧化還原和代謝方面具有協同效應,因此,癌細胞中xCT 和ASCT2的基因缺失會導致腫瘤生長減慢,這使得它們成為抗癌藥物開發的靶點[28] 。
值得注意的是,SLC7A11 是鐵死亡的抑制因子[29] ,能夠促進癌細胞的存活。因此,轉錄因子NF-E2 相關因子2(nuclear erythroid 2-related
factor2, Nrf2)和p53 為發揮腫瘤調控功能,通常協同參與調控SLC7A11 的表達來發揮抗氧化功能,并影響腫瘤細胞鐵死亡進程[30-31] 。與之類似的是,在肺癌細胞中RNA 結合基元單鏈結合蛋白1(RNA bindingmotif, single
stranded interacting protein 1, RBMS1)可以通過調控SLC7A11 的翻譯來影響腫瘤細胞的鐵死亡,從而介導肺癌細胞的生長調控[32] 。研究表明,氨基酸轉運體SLC7A11 不僅能負責氨基酸的轉運,還能調控腫瘤細胞的鐵代謝。另一方面,與SLC7A11介導腫瘤細胞鐵死亡機制不同的是,在葡萄糖缺乏的情況下,SLC7A11能介導通過磷酸戊糖途徑產生的煙酰胺腺嘌呤二核苷酸(nicotinamideadeninedinucleotide
phosphate, NADPH) 將胱氨酸還原為半胱氨酸。如果腫瘤細胞在高表達SLC7A1情況下,缺少葡萄糖,則會導致細胞發生氧化應激后快速死亡。這進一步表明,SLC7A11 介導的胱氨酸代謝與癌細胞的其他代謝之間存在關聯,其能夠協調磷酸戊糖途徑的進程來參與腫瘤細胞代謝重編程[33] 。
2 腫瘤代謝循環過程中的氨基酸
2. 1 谷氨酰胺及谷氨酸代謝
谷氨酰胺是被機體攝取最多的氨基酸, 參與一系列的生物反應,包括能量生成、大分子合成以及信號轉導。在多種癌細胞中,谷氨酰胺是僅次于葡萄糖為腫瘤細胞提供能量的物質,因此,與腫瘤的發生發展密切相關。由于癌細胞的氨基酸需求增加,致使谷氨酰胺在細胞快速增殖過程中始終依賴于外源供應,即腫瘤細胞的“谷氨酰胺依賴現象”[34] 。腫瘤細胞的增殖會消耗氧氣,導致腫瘤微環境處于缺氧狀態,因此,為滿足其能量要求其主要碳源來源于谷氨酰胺[35] 。研究發現,在免疫細胞、小腸細胞和一些癌細胞在內的快速增殖細胞中,谷氨酰胺除了提供氮、碳的生物合成反應外,還在細胞能量學和降低癌細胞氧化應激方面發揮重要作用[36] 。由于谷氨酰胺酶(glutaminase, GLS)介導谷氨酰胺的分解代謝,并能夠為腫瘤增殖提供所需原料,目前,關于GLS 調控腫瘤生長的機制研究較多。例如,胰腺導管癌的生長和存活對于谷氨酰胺表現出很強的依賴性,其細胞GLS 的表達水平較高。且高表達的GLS通常出現琥珀酰化修飾來增強自身活性,這樣能通過增強谷氨酰胺的分解代謝來促進細胞的存活[37] 。而且,腫瘤細胞增殖過程中的大多數非必需氨基酸都直接來源于谷氨酰胺[38] 。
研究發現,在腫瘤細胞的谷氨酰胺合成過程中,谷氨酰胺代謝酶受到腫瘤細胞轉錄因子的精確調控,這些轉錄因子可以通過影響谷氨酰胺代謝酶(glutamine synthetase, GS)的表達水平和酶活性來調控谷氨酰胺代謝和腫瘤細胞的生物學活動。例如,轉錄因子c-Myc 可以抑制miR23a/ b 的表達來回補三羧酸(TCA)循環,并在此過程中上調GLS 的表達,從而上調谷氨酸代謝量[39]。與之類似的是,腫瘤抑制因子p53 也能通過與蘋果酸酶(malic en-zyme, ME)基因的共有反應元件結合來抑制所有ME 同種型基因的表達,從而調節谷氨酰胺代謝、NAPDH 產生、氧化還原狀態以及生物合成[40] 。有趣的是,除了與轉錄因子相互作用參與腫瘤代謝調控外,最新發現,GS 能夠通過直接促進腫瘤細胞的有絲分裂來增強其增殖,而這種調控細胞周期的功能卻獨立于GS 的代謝酶功能[41] 。以上研究表明,谷氨酰胺在細胞增殖、生物合成反應和氧化還原穩態提供碳和還原氮中具有重要功能。另外,在腫瘤細胞發展過程中,消耗血清中的谷氨酰胺、阻斷細胞對谷氨酰胺的攝取,以及抑制參與谷氨酰胺合成或分解代謝的酶等均能影響腫瘤細胞的增殖。因此,靶向谷氨酰胺代謝過程中的部分關鍵酶和中間代謝物,已被證實可以調控腫瘤代謝過程,甚至進一步影響腫瘤的生長。
2. 2 天冬氨酸和天冬酰胺代謝
天冬氨酸與天冬酰胺屬于非必需氨基酸,可部分依賴于體內生物合成。在腫瘤細胞內,天冬氨酸和天冬酰胺不僅會參與腫瘤細胞的增殖,還會調控癌細胞內的信號傳導。研究發現,天冬酰胺合成酶(asparagine synthetase, ASNS)在體內的表達量密切影響著癌癥的發生發展,腫瘤細胞在谷氨酰胺不足或缺失的情況下,外源補充天冬酰胺可維持蛋白質的翻譯并促進腫瘤細胞的生長[42] 。與之類似的是,在缺乏谷氨酰胺的內皮細胞中,天冬酰胺對于恢復蛋白質合成、抑制內質網應激以及重新激活mTOR信號傳導至關重要[43] 。進一步的研究發現,敲除天冬酰胺合成酶或限制飲食中的天冬酰胺,可減少腫瘤的轉移而不影響原發性腫瘤的生長,而增加飲食中的天冬酰胺或增強天冬酰胺合成酶表達會促進腫瘤轉移發生[44] 。之前的研究已發現,ASNS 的表達缺陷會導致細胞對天冬酰胺的限制異常敏感,通過實驗進一步證實,限制天冬酰胺可激活腫瘤細胞內的其他信號通路,限制與此有關的信號通路,將會使得腫瘤細胞的生長更容易因天冬酰胺的限制受到限制[45] 。值得注意的是,除了直接調控腫瘤的轉移外,天冬酰胺還能通過與腫瘤內其他信號分子相互作用以間接調控腫瘤的發展。有研究發現,p53 通過轉錄下調ASNS 表達抑制天冬酰胺合成,并且能通過破壞天冬酰胺-天冬氨酸穩態,抑制體內和體外淋巴瘤和結腸腫瘤生長[46] 。這些研究表明,不僅外源的天冬酰胺會影響腫瘤細胞的增殖,內源天冬酰胺水平的穩定對于腫瘤細胞內部信號傳導也具有調控作用。
2. 3 絲氨酸和甘氨酸代謝
絲氨酸和甘氨酸對于腫瘤細胞的增殖極其重要,其代謝過程中的部分代謝物或關鍵酶會調控腫瘤細胞的生長。當絲氨酸外源補充不足時,腫瘤細胞可通過絲氨酸合成途徑(serine synthesis pathway,SSP)產生內源性絲氨酸。在癌細胞中,糖酵解的產物三磷酸甘油酸,在磷酸甘油酸脫氫酶(phosphoglyceratedehydrogenase,
PHGDH)和NADPH 的參與下生成磷酸羥丙酮酸,再經過一系列反應生成絲氨酸。PHGDH 作為絲氨酸合成的關鍵酶,在調控腫瘤細胞增殖和遷移過程中極其重要。有研究發現,在結直腸癌細胞快速轉移過程中,絲氨酸、甘氨酸和S-腺苷甲硫氨酸(SAM)的含量會出現增加的現象。這是由于結直腸癌細胞會通過誘導單泛素化修飾來增強PHGDH 的活性,間接促進結直腸癌細胞一碳單位代謝[47] 。與之類似的是,腫瘤細胞在SSP過程中,SSP 酶的表達或驅動絲氨酸合成增強的癌基因活化,會使細胞對絲氨酸和甘氨酸饑餓療法產生抗性。因此,通過抑制PHGDH 的表達并協同絲氨酸和甘氨酸饑餓療法,可以抑制腫瘤一碳代謝和癌癥生長[48] 。同時,也有研究表明,SSP 過程中的磷酸絲氨酸轉氨酶( phosphoserine aminotransferase,PAST)的缺失,或從飲食中去除絲氨酸對于抑制結直腸癌異種移植物的生長和增強5-氟尿嘧啶(5-fluorouracil,5-FU)的抗腫瘤活性極其重要[49] ,研究表明,內源性或外源性的絲氨酸都有助于結直腸癌的生長和腫瘤細胞對5-FU 的抗性。
腫瘤細胞內的甘氨酸不僅有多種合成方式,而且其合成途徑中的許多代謝酶通過與轉錄因子相互作用參與腫瘤生長調控。例如,c-Myc 和活化轉錄因子4(activating transcription factor 4, ATF4)可以轉錄調控絲氨酸羥甲基轉移酶(serine hydroxy methyltransferase, SHMT)影響腫瘤細胞生長[50] ,腫瘤抑制因子p53 也可以調控甲基四氫葉酸脫氫酶(methylenetetrahydrofolatedehydrogenase, MTFHD),以響應細胞增殖和DNA 損傷[51] 。值得注意的是,絲氨酸的缺乏不僅會導致甘氨酸合成受阻,還會影響腫瘤細胞的生長和核苷酸的合成。但是,與甘氨酸缺乏對腫瘤細胞的影響相比,線粒體甘氨酸的生物合成途徑受阻會嚴重影響腫瘤細胞的增殖[52] 。此外,通過建立異種移植和同種異體移植的大鼠模型發現,大鼠攝取絲氨酸和甘氨酸的含量下降后,確實可以減少腫瘤細胞的生長[53-54] 。這一系列研究表明,絲氨酸或者甘氨酸的代謝對于腫瘤生長及其重要, 其關鍵代謝途徑或代謝酶與腫瘤因子之間存在相互作用。因此,靶向絲氨酸或甘氨酸代謝或能成為腫瘤治療的關鍵策略。
2. 4 精氨酸代謝
與正常人體細胞相比,某些具有營養缺陷型的癌細胞具有更高的營養需求。精氨酸作為一種多功能氨基酸,在代謝和信號通路中具有多種生物學功能,其在癌細胞中的含量和相關代謝通路對腫瘤細胞的生長具有重要影響。精氨酸是腫瘤細胞合成蛋白質合成所必需的,也是合成尿素、一氧化氮、多胺、脯氨酸和胍丁胺等幾種分子的前體[55] 。有報道指出,精氨酸對于免疫系統應答、心血管以及肝腎系統正常功能等有重要作用[56] 。在正常細胞中,瓜氨酸經過一系列分解代謝形成精氨酸和琥珀酸,其中精氨琥珀酸合成酶(arginine succinate synthase, ASS)是精氨酸合成過程中的限速酶。然而,在大多數類型癌癥中ASS 表達水平較低,呈現外源精氨酸依賴性,因而ASS 可作為治療癌癥的重要靶點[57]。研究發現,轉錄因子c-Myc 和缺氧誘導因子1α(hypoxiainducible factor-1α, HIF-1α)可以轉錄調控ASS1 的表達,并且抗癌藥物順鉑能夠通過上調HIF-1α 和下調c-Myc 來抑制ASS1 的表達,從而協同精氨酸饑餓療法以抑制腫瘤細胞的生長[58] 。值得注意的是,最新研究發現,在ASS1 基因低表達的肝癌患者中,過表達ASS1基因能夠通過激活蛋白激酶R 樣內質網激酶(PKR-like ER kinase, PERK) / 真核起始因子2 的α 亞基(α subunit of eukaryotic initiation factor2, eIF2α) / ATF4 / C/ EBP 同源蛋白(C/ EBP-homologousprotein, CHOP)信號通路,抑制腫瘤生長并增強體外和體內藥物化療的療效,且ASS1 的表達與患者良好的預后相關[59]。
有研究表明,許多實體瘤不能合成精氨酸,因而促進腫瘤細胞內精氨酸的降解為治療癌癥提供了另一思路。精氨酸降解后能夠產生包括尿素、鳥氨酸和多胺等在內的代謝產物。其中多胺是小的有機聚陽離子,在DNA 復制、翻譯和細胞增殖方面扮演著重要的角色[60] 。鳥氨酸脫羧酶1(ornithine decarboxylase1, ODC1)是多胺合成中的限速酶,影響腫瘤的發生發展,并在腫瘤細胞中出現高表達[61] 。值得注意的是,有研究發現,p53能夠轉錄抑制氨甲酰基磷酸合成酶I ( carbamoyl phosphate synthetase,CPS Ⅰ)、鳥氨酸氨甲酰基轉移酶(ornithine transcarbamylase,OTC)和I 型精氨酸酶(arginase I, ARGI)的表達,從而抑制腫瘤細胞尿素的產生和氨的解毒功能,導致細胞因氨毒性死亡[62] 。另外,ASS、ARGI和ARGII、誘導型一氧化氮合酶(iNOS)、精氨酸脫羧酶(arginine decarboxylase, ADC)以及過氧化氫酶(CAT)活性均顯示能影響精氨酸的合成和分解代謝[63-64] 。研究表明,精氨酸代謝過程中的代謝物能夠參與腫瘤細胞的尿素循環并受轉錄因子p53 的調控。
2. 5 半胱氨酸和胱氨酸代謝
半胱氨酸是一類半必需氨基酸,在正常細胞中,其不僅參與蛋白質合成,還會影響細胞的氧化還原穩態。然而,腫瘤細胞中的半胱氨酸和胱氨酸在為腫瘤細胞的增殖提供能量的同時,又會通過調控腫瘤細胞的信號傳導介導腫瘤的生長。最近的研究表明,在某些情況下,半胱氨酸的缺乏不僅可以阻礙癌細胞的增殖,還可觸發鐵死亡[65] 。因而半胱氨酸饑餓療法被用于抑制小鼠癌癥模型中的腫瘤生長[66] 。在半胱氨酸代謝過程中,半胱氨酸雙加氧酶已被證明與腫瘤的耐藥性、不良預后相關[67-68] ;同時,其代謝過程中的胱硫醚β-合酶(cystathionine-beta-synthase,CBS)也被證明與惡性腫瘤的增殖、遷移和擴散有關[69-70] 。此外,在細胞培養基中去除半胱氨酸后發現極大地增強了單磷酸活化蛋白激酶(AMPactivatedprotein kinase, AMPK)活性;進一步研究發現,一種可直接結合半胱氨酸的半胱氨酰tRNA 合酶(cysteinyl-tRNA synthetase, CARS) 可以結合鈣/鈣調蛋白依賴性蛋白激酶激酶2(calcium/ calmodulindependent protein kinase kinase 2, CaMKK2),從而感知半胱氨酸的缺失并激活AMPK,最后調節腫瘤細胞生長[71] 。總而言之,這些研究表明,半胱氨酸及胱氨酸的代謝在腫瘤發生發展過程中具有調控功能。
2. 6 脯氨酸代謝
脯氨酸代謝在腫瘤代謝重編程中發揮重要作用,影響著癌癥的發生和發展。脯氨酸代謝與腫瘤細胞中的ATP 產生、蛋白質和核苷酸合成以及氧化還原穩態有關。通過分析大量癌細胞系發現,脯氨酸饑餓或抑制脯氨酸生物合成酶會抑制細胞的克隆形成和致瘤的能力。同時,進一步研究發現,部分依賴外源脯氨酸的癌細胞表現出mTORC1 介導的4E結合蛋白1(4EBP1,一種細胞信號傳導蛋白)信號軸的過度激活,以及內質網(endoplasmic reticulum,ER)應激反應;若外源補充脯氨酸可減輕ER應激,并促進細胞穩態和克隆形成[72] 。除此之外,在脯氨酸代謝酶中,吡咯琳-5-羧酸還原酶(pyrroline-5-car-boxylatereductase, P5CR) 在多種類型癌癥中高表達,并且促進腫瘤的生長。而且,沉默調節蛋白3(sirtuin 3, SIRT3)在體內和體外均能與P5CR1 相互結合并去乙酰化P5CR1,增加P5CR1 的活性,從而促進腫瘤的生長[73] 。由于脯氨酸在癌癥代謝中發揮特殊的作用,抑制脯氨酸的生物合成可以抑制腫瘤生長[74] 。
在腫瘤細胞中,脯氨酸的降解類似于其合成的逆反應,其中脯氨酸脫氫酶(proline dehydrogenase,PRODH) 是由腫瘤抑制因子p53 誘導的基因之一[75] 。脯氨酸分解代謝不僅支持3D 培養的腫瘤細胞生長,還能促進腫瘤細胞的轉移;通過抑制脯氨酸代謝過程中的PRODH 可以抑制腫瘤的轉移[76] 。而另有研究發現,在腫瘤細胞中過表達脯氨酸氧化酶(proline oxidase, POX)可以通過增加活性氧(reactiveoxygen species, ROS)表達誘導腫瘤細胞發生凋亡[77] ,這可能與脯氨酸代謝過程中腫瘤細胞的氧化還原狀態相關。與之類似的是,腫瘤細胞在低氧條件下,POX 通過產生ROS介導自噬信號以維持腫瘤細胞的存活,進一步表明脯氨酸代謝是潛在的腫瘤治療靶點[78] 。
2. 7 蛋氨酸代謝
在正常細胞中,蛋氨酸的攝取和代謝涉及包括甲基化反應、氧化還原維持、葉酸代謝和多胺合成在內的許多細胞生物學功能,這些功能能夠協調細胞核苷酸的合成和氧化還原狀態的穩定。在許多情況下,這些功能與癌癥的發病機制相關。研究發現,蛋氨酸作為S-腺苷蛋氨酸( S-adenosyl methionine,SAM)的底物,是癌細胞重要的甲基供體和必需氨基酸, 腫瘤細胞在異常增殖過程中會大量攝取蛋氨酸,并代謝成為SAM 來維持其重編程的需要。研究發現,哺乳動物細胞需要活化的葉酸來產生用于生長和分裂的核苷酸。在癌細胞中,四氫葉酸(tetrahydrogenfolic acid, THF)能將一個碳單位轉移到氨基酸、核苷酸或其他分子上,因此,在核酸和蛋氨酸的合成中具有重要作用。其中5-甲基四氫葉酸(5-methyl-THF)能夠在鈷胺素依賴性蛋氨酸合酶(methioninesynthase, MTR)的作用下,將同型半胱氨酸轉換成蛋氨酸并生成THF。有研究發現,MTR 能夠通過維持THF的代謝穩態,控制腫瘤細胞的生長[79-80] 。研究表明,MTR 不僅能參與蛋氨酸循環,還能通過調控蛋氨酸循環參與葉酸代謝,這為蛋氨酸的膳食干預與抗葉酸療法的結合提供了思路。
2. 8 支鏈氨基酸的代謝
支鏈氨基酸( branched-chain amino acids,BCAAs)作為氮供體為腫瘤細胞的增殖需求提供核苷酸等大分子合成原料,對于癌細胞的生長是不可或缺的。BCAAs 除了直接參與蛋白質合成外,還能通過分解代謝產生谷氨酸等中間代謝物,從而與其他代謝途徑相關聯[81] 。例如,癌細胞中的BCAAs通過LAT1 進入細胞,然后由溶質載體家族25成員44(solute carrier family 25 member 44, SLC25A44)蛋白將其轉運到線粒體[82] 。腫瘤細胞內的BCAAs 通過支鏈氨基酸轉氨酶(branched-chain aminotransferase,BCATs)轉化為包括α-酮異己酸(α-ketoisocaproate,KIC)、α-酮-β-甲基戊酸(α-keto-β-methylvalericacid,α-KMV)以及α-酮異戊酸(α-Ketoisovalericacid, KIV)在內的支鏈α-酮酸(branched-chainα-ketoacid, BCKAs),同時將氨基從BCAAs 轉移到α-酮戊二酸(α-Ketoglutaric acid, α-KG) 生成谷氨酸。因此,BCATs 不僅能控制BCAAs 和BCKAs的水平,還能調控腫瘤細胞內α-KG 和谷氨酸的水平[83] 。腫瘤細胞中BCAAs 代謝的重編程是由參與BCAAs 代謝途徑的BCAAs 轉運體和代謝酶的表達以及活性的改變決定的。有研究報道稱,BCAAs 代謝與胰腺導管腺癌(pancreatic ductal adenocarcinoma,PDAC)的發展有關,通過降低膳食中BCAAs 的水平或者采用支鏈氨基酸轉氨酶2(branched chainaminotransferase 2, BCAT2) 的抑制劑,能減緩小鼠PDAC 的生長[84] 。此外,BCAT1 的啟動子區含有多種轉錄調節因子的結合位點,包括c-Myc、HIF-1 和SMAD5[85-86] ,這些轉錄調節因子均可以通過調控BCAT1 進而調控支鏈氨基酸的代謝,并對腫瘤代謝產生影響。Fig. 1 為腫瘤細胞中的氨基酸代謝。
3 氨基酸代謝與腫瘤mTOR 信號通路
癌細胞中的mTOR 能夠調節蛋白質翻譯并參與腫瘤細胞的生長和自噬調控。因此,mTOR 信號的傳遞和激活對于腫瘤細胞的生長和代謝活動極其重要。值得注意的是,氨基酸是激活mTOR 所必需的,而mTOR 能通過調控物質的分解代謝過程來控制細胞生長。早期的研究發現,細胞培養基中的氨基酸缺失能夠顯著抑制mTOR 下游底物的磷酸化。研究表明,mTOR 能夠感應氨基酸的變化[87] 。氨基酸作為蛋白質合成的關鍵原料,能夠直接結合氨基酸受體被細胞感知,進而將信號傳遞給mTOR。因此,mTOR能通過響應氨基酸水平控制腫瘤細胞的生長[88] 。
3. 1 氨基酸轉運體調節mTOR 活性
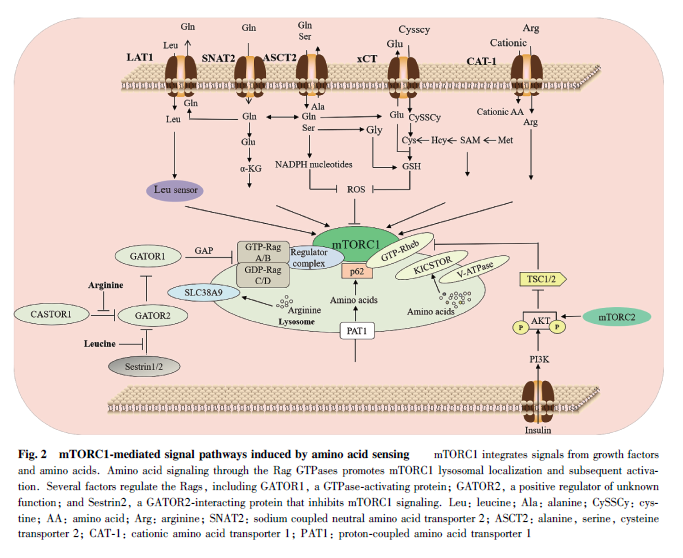
氨基酸轉運體負責腫瘤細胞的內外氨基酸的交換,這意味著在腫瘤細胞在發生發展過程中,氨基酸轉運體能夠通過調節mTOR 活性控制腫瘤細胞的生長。研究發現,腫瘤細胞內mTOR 通過與其他分子形成復合物發揮生物效應,其包含兩種復合體,分別為mTORC1 和mTORC2 復合物。腫瘤細胞內的多種氨基酸轉運體在激活mTORC1 和促進細胞增殖過程中發揮關鍵作用(見Fig. 2)。例如,LAT1 通過激活mTORC1 的活性來促進體外和體內的癌細胞增殖,而LAT1 的敲除則會破壞腫瘤氨基酸的穩態,并降低mTORC1 的活性,從而減少小鼠異種移植腫瘤的生長[89] 。其他的研究也表明,LAT1 基因的敲除會導致骨肉瘤和胸腺瘤細胞發生凋亡[21, 90] 。這進一步證實了LAT1 對mTORC1 活性的調控功能。與之類似,在許多異種移植模型中也發現,ASCT2 基因的敲除會顯著降低mTORC1 活性和腫瘤生長[91] 。除上述位于細胞質膜上的氨基酸轉運體外,腫瘤細胞內的氨基酸轉運體也能調控mTORC1 的活性。細胞內的質子偶聯氨基酸轉運蛋白1(proton-coupled amino acid transporter 1,PAT1)是位于溶酶體表面的氨基酸轉運蛋白質,其會與RAS 相關的小G 蛋白( ras-related smallGTP- binding protein) 亞型 Rag GTP 酶發生相互作用,并在氨基酸依賴的mTORC1 激活中具有重要作用[92] 。最近的研究證實,PAT1 基因的過表達會活化mTORC1,并增強癌細胞對細胞周期蛋白依賴性激酶(cyclin-dependent kinases, CDK)4 /的耐藥性[93] 。除此之外,溶質載體家族38 成員9 ( solute carrier family 38 member 9,SLC38A9)也被報道能在溶酶體膜上與Rag GTP酶相互作用,進而影響mTORC1的活性[94] 。這些研究均表明, 氨基酸轉運體可以通過調控mTORC1 的活性影響腫瘤細胞的增殖。
3. 2 氨基酸調節mTOR 活性
近年來,除上述的氨基酸轉運體外,細胞內氨基酸的精準感受器作為重要信號分子參與腫瘤細胞的代謝調控作用受到廣泛關注。研究表明,GATOR2復合物是mTORC1 感知氨基酸信號通路中的關鍵正調控因子。亮氨酸的缺乏會通過亮氨酸傳感器SAR1B 傳遞給mTORC1。在傳遞過程中,SAR1B 會通過自身構象的變化來靶向其激活劑GATOR2,從而間接調控mTORC1 活性,并在癌癥的發展過程中發揮重要作用[95] 。與之類似的是,有研究發現,亮氨酸的缺乏會增強應激誘導蛋白Sestrin2 與GATOR2的相互作用,進而影響mTORC1 的表達[96] 。值得注意的是,在Sestrin2 與GATOR2 相互作用的過程中,泛素連接酶環指蛋白167(ring finger protein167, RNF167)和去泛素化酶STAM 結合蛋白樣1(STAM binding protein-like 1, STAMBPL1)能協同調控Sestrin2 的多聚泛素化修飾水平,并影響Sestrin2調控mTOR 的機制,最后對結直腸癌的發生發展產生影響[97] 。其他的研究也逐步揭示,精氨酸、亮氨酸或者谷氨酰胺等均可以通過感應器或者代謝產生的ROS 對mTOR 產生作用,從而調控腫瘤細胞的增殖。然而,也有研究發現,與胱氨酸轉運體SLC7A11介導的鐵死亡不同的是,當腫瘤細胞中的半胱氨酸缺乏時,其可以通過抑制mTORC1 信號通路調控鐵死亡[98] 。這進一步強調了氨基酸代謝對于mTOR活性調控的復雜性。這些研究表明,在腫瘤細胞代謝過程中,mTORC1 作為氨基酸的核心感應信號,在調節惡性腫瘤細胞的增殖和鐵死亡等方面發揮了重要的生物學功能。Fig. 2 為mTORC1 介導的氨基酸感應的信號通路。
4 氨基酸代謝與腫瘤免疫
4. 1 氨基酸代謝與腫瘤微環境的關系
腫瘤的發生與發展,除了與自身細胞的惡性增殖相關外,還與其生存的環境有關,是影響腫瘤治療的重要因素。其中,免疫細胞和免疫系統是腫瘤微環境的重要組成部分,一旦腫瘤微環境中的免疫細胞代謝發生改變或免疫系統受到破壞,就會導致腫瘤的惡化。研究發現,腫瘤細胞可以利用多種氨基酸來支持其增殖和轉移。在這個過程中,腫瘤細胞中產生的下游代謝物被釋放到腫瘤微環境中。一些代謝物表現出免疫調節特性,可以直接靶向和損害免疫細胞的功能。此外,轉運蛋白質高表達腫瘤細胞會與免疫細胞競爭氨基酸,損害免疫細胞的功能[99-101] 。由于腫瘤細胞具備代謝重編程的能力,因此,能夠適應腫瘤微環境(tumor microenvironment,TME)中的酸性或缺氧的不良環境。而包括NK 細胞在內的許多免疫細胞則需要葡萄糖來提供能量物質,以實現其抗腫瘤反應。然而,NK 細胞由于缺乏代謝適應性,在TME 中會受到代謝抑制。如果增加NK細胞在TME 中的代謝靈活性,將會提高NK 細胞的免疫毒性功能,并特異性增強抗腫瘤活性的機制[102] 。研究表明,TME 對于腫瘤細胞自身和免疫細胞極其重要。有趣的是,部分氨基酸及其代謝物既會影響腫瘤細胞的生長,又會對腫瘤微環境中的免疫細胞產生影響。例如,谷氨酰胺拮抗劑通過抑制腫瘤細胞的糖酵解代謝,在發揮抑制癌細胞生長功能的同時,又可以通過破壞腫瘤的免疫抑制微環境來克服腫瘤的免疫逃逸[103] 。與之類似的是,當調節性T 細胞受到谷氨酰胺的刺激時會增殖并上調IL-2 及IL-2 受體的表達,再通過一些中間代謝產物來促進骨髓來源的抑制性細胞(myeloid-derivedsuppressor cells, MDSCs) 成熟。最終,成熟的MDSCs會通過抑制腫瘤特異性T細胞的功能來介導腫瘤免疫逃逸[104] 。這意味著,谷氨酰胺不僅能夠作為能量物質為腫瘤細胞和免疫細胞提供能量,而且,其在TME 中的含量會影響免疫細胞的成熟和免疫因子的釋放。除谷氨酰胺外,TME 中的精氨酸和色氨酸代謝,也在腫瘤細胞的免疫調節方面扮演重要的角色。癌細胞和巨噬細胞會通過攝取和分解代謝,局部消耗TME 中的色氨酸,從而抑制抗原特異性T 細胞反應[105] 。與色氨酸一樣,TME中細胞外精氨酸的可用性,會影響T 細胞抗腫瘤反應的幅度和持續時間[106] 。當癌細胞內的精氨酸被MDSCs 和巨噬細胞迅速分解代謝后,會表現出精氨酸缺乏的狀態。而細胞毒性T 細胞對局部氨基酸可用性的波動很敏感,當局部精氨酸耗盡時,它們的效應物和抗腫瘤活性會顯著降低[107-108] 。這些研究表明,TME 中的氨基酸代謝與腫瘤細胞的發生發展和腫瘤免疫密切相關。
4. 2 氨基酸代謝與免疫細胞功能的關系
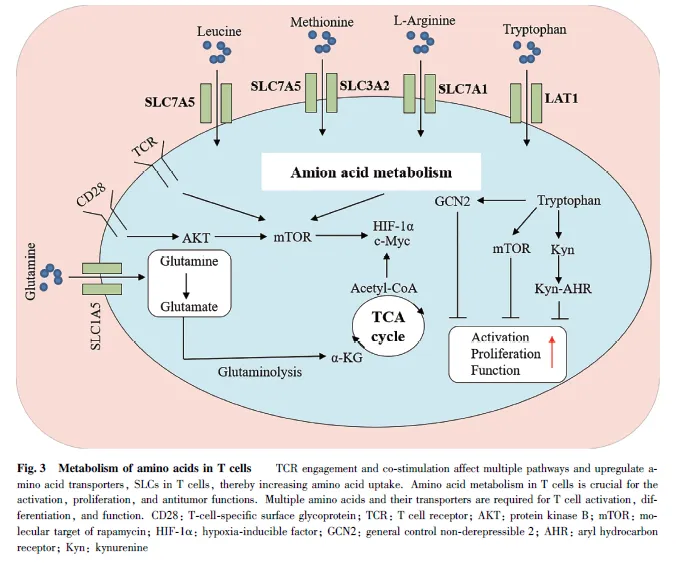
氨基酸代謝可以調控多種類型的免疫細胞功能,而且免疫細胞依賴于氨基酸代謝獲得能量和生物基質,并通過激活其代謝過程中的關鍵酶或中間代謝物來維持其效應功能[109] 。由于細胞攝取氨基酸依賴于氨基酸轉運體的精確調控,并且氨基酸轉運體能控制免疫細胞功能,因此,不同類型的免疫細胞表達的轉運蛋白質和受體存在差異,且不同類型的抗原和細胞因子會改變轉運蛋白質的表達。例如,CD8+ T 細胞在細胞因子的作用下,通過T 細胞受體(T-cell receptor, TCR)的刺激并活化;由于活化的T 細胞需要更多的氨基酸供應來支持增殖,因此,活化的CD8+T 細胞表面溶質載體家族1 成員5(solute carrier family 1,member 5, SLC1A5)和溶質載體家族7 成員5(solute carrier family 7,member 5,SLC7A5)的表達量高于未活化的CD8+ T 細胞[110] ,而且氨基酸轉運體的不對稱分布也會影響T 細胞的分化[111] 。有趣的是,腫瘤細胞與免疫細胞在TME 中存在營養攝取競爭。當細胞通過mTORC1信號通路進行程序化的營養分配時[112] ,如果腫瘤細胞溶質載體家族43 成員2(solute carrier family43,member 2, SLC43A2)的表達水平升高,則會與T細胞競爭TME 中的蛋氨酸。一旦T 細胞缺乏甲硫氨酸,將會導致T 細胞的效應功能直接受損[113] 。與之類似的是,骨髓細胞是促進腫瘤生長和免疫逃避的腫瘤微環境的主要成分,通過抑制谷氨酰胺代謝能顯著增加炎癥性腫瘤相關巨噬細胞(TAM)的水平,并進一步導致腫瘤生長和轉移減少[114] 。這進一步表明,氨基酸轉運體對于免疫細胞功能的重要性。
最新的研究發現,氨基酸的供給對于免疫細胞的激活同樣至關重要。天冬酰胺(asparagine, Asn)作為一種非必需氨基酸,能夠通過直接結合淋巴細胞特異性酪氨酸蛋白激酶(lymphocyte-specific proteintyrosine kinase, LCK)來增強LCK 的信號傳導和T 細胞的活化,并且無論在細胞水平還是大鼠體內均被證實,可以活化CD8+ T 細胞并增強抗腫瘤反應。反之,通過各種手段減少天冬酰胺的水平則會削弱CD8+T 的活性和效應T 細胞的產生[115] 。與天冬酰胺類似的是,無谷氨酰胺培養的T 細胞不能增殖或產生白介素2(Interleukin-2, IL-2)或γ-干擾素(Interferon γ, IFN-γ)[116] ,如果限制谷氨酰胺則會增加癌細胞中程序性細胞死亡受體-1(programmedcell death-1, PD-1)的水平,導致共培養的T 細胞失活[117] 。與之類似的是,絲氨酸能刺激谷胱甘肽(Lglutathione,GSH)合成,并維持調節性T 細胞(regulatoryT cells, Tregs)的功能[118] (見Fig. 3)。但與上述研究不同的是,在三陰性乳腺癌中,谷氨酰胺代謝基因與T細胞介導的細胞毒性標志物之間存在負相關,增加谷氨酰胺代謝可以降低T 細胞細胞毒性并提高腫瘤的存活率。因此,靶向腫瘤GLS 或減少谷氨酰胺代謝則可以改善抗腫瘤T 細胞的效應功能[119] 。除了氨基酸直接參與腫瘤免疫過程外,氨基酸代謝途徑中的部分關鍵酶也會參與免疫細胞的功能調控。有研究發現,巨噬細胞在IFN-γ 或脂多糖(lipopolysaccharide,LPS)的刺激下,能促進信號轉導和轉錄激活因子1(signal transducers and activator oftranscription 1, STAT1)介導的ASS1 轉錄,導致瓜氨酸消耗增多,從而介導炎癥信號的激活。同時,瓜氨酸的增多會直接與非受體型酪氨酸蛋白激酶2(Januskinase 2, JAK2)結合,并抑制JAK2-STAT1 信號傳導。研究表明,ASS1 在以消耗細胞瓜氨酸的方式控制炎性巨噬細胞活化和抗菌防御的過程中發揮關鍵核心作用,并通過其代謝物介導先天免疫信號的傳遞參與促炎反應的代謝檢查[120] 。
5 靶向氨基酸代謝的腫瘤治療
腫瘤細胞的代謝重編程是為了滿足其增殖過程中的物質和能量需求。早期的癌癥療法使用抗代謝物來破壞腫瘤代謝,但隨著對腫瘤代謝研究的深入,研究發現,許多癌癥表現出偏好特定氨基酸的特征, 并且腫瘤細胞在增殖過程中,對外源氨基酸的供應極其敏感,通過減少血清中的氨基酸含量、限制氨基酸的轉運或者通過分解氨基酸代謝酶的方式均能影響腫瘤細胞的生長。值得注意的是,與腫瘤細胞相比,正常細胞對氨基酸的需求較低,并且其在營養應激條件下合成目標氨基酸的能力較低。這使得靶向氨基酸代謝成為一種對正常細胞損傷小,且有效的手段[121] 。目前,氨基酸消耗療法是通過使用異源、重組或工程化酶的方式來靶向氨基酸攝取和分解代謝,從而實現對腫瘤代謝重編程的調控。
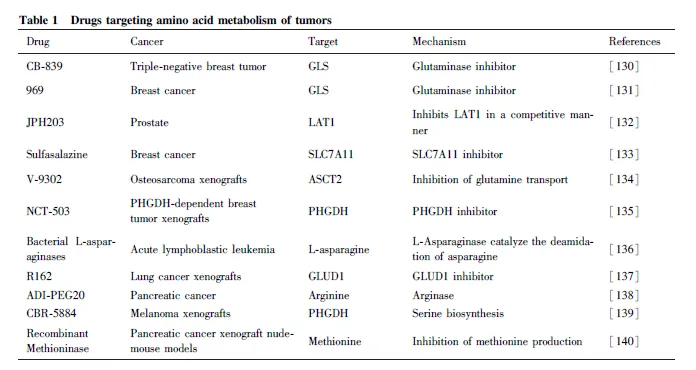
天冬酰胺(Asn)和谷氨酰胺對于腫瘤細胞的生長及其重要,其中Asn 饑餓對于誘導低水平表達或ASNS缺乏的白血病或淋巴瘤癌細胞作用明顯[122] ,而ASNase單一療法一直是治療白血病和一些淋巴瘤病例的有效方法。有報道稱,采用ASNase 與長春新堿、潑尼松和阿霉素可誘導細胞凋亡并治療白血病[123-124] 。同時,鑒于Gln 在腫瘤細胞存活中的關鍵作用,已通過藥理學GLS 抑制劑直接靶向該途徑。在臨床研究中,GLS 抑制劑CB-839 已被證明能夠降低線粒體氧化磷酸化,抑制人急性髓系白血病細胞(acute myeloid leukemia, AML) 細胞的生長。癌細胞需要精氨酸來維持生長,因此,耗盡內源性Arg 是一種潛在的治療干預措施。研究發現,使用聚乙二醇化形式的精氨酸脫亞胺酶(PEGylated argininedeiminase, ADI-PEG20)或精氨酸酶靶向Arg 代謝,或尿素循環的兩種關鍵酶來治療腫瘤是一種有效的策略[125] 。同時,ADI 將Arg 降解為瓜氨酸在預防黑色素瘤、肺癌、腎細胞癌和肝細胞癌等腫瘤細胞增殖方面具有有益作用[126-127] 。除此之外,Cramer等設計了與PEG 偶聯的半胱氨酸酶,可降低血清中的半胱氨酸水平并消耗細胞外半胱氨酸,逐漸成為一種癌癥的治療工具。研究發現,半胱氨酸酶處理腫瘤細胞后可通過抑制mTOR 活性,并介導細胞內ROS 積累增加和自噬增加, 從而發揮抑癌功能[128-129] 。這一系列的研究表明,在癌癥的治療過程中,通過設計靶向腫瘤氨基酸代謝過程中的轉運體、代謝物或代謝酶已成為一種有效的治療手段。Table 1 為靶向腫瘤氨基酸代謝的藥物 。
6 問題與展望
腫瘤細胞在異常增殖過程中,為獲取更多的物質和能量,通常需要通過改變自身的代謝方式或增加代謝量。其中,腫瘤代謝重編程不僅涉及到葡萄糖和脂質代謝,還涉及到氨基酸代謝的改變。在腫瘤細胞中,氨基酸一方面能直接作為蛋白質合成的成分,另一方面又能作為能量代謝的中間產物參與腫瘤細胞的生長過程。在調控腫瘤功能方面,不僅可以通過細胞內的氨基酸轉運體、感應器或者自身代謝產生的中間產物、酶等參與許多生物學過程,還能通過調控代謝途徑改變腫瘤微環境或細胞內信號通路,從而實現對腫瘤細胞的生長調控作用。值得一提的是,氨基酸的代謝對于免疫細胞的激活或者分化等具有重要的生物學功能,可以通過調控免疫細胞及免疫因子的產生對腫瘤免疫產生影響。這不僅體現了氨基酸作為藥物治療靶點在治療腫瘤方面的巨大潛力,也進一步表明可以通過調控氨基酸代謝為腫瘤免疫提供治療輔助。
隨著研究的深入,發現相較于正常細胞來說,腫瘤細胞對于氨基酸的需求和依賴性更加偏重。因此,針對氨基酸代謝治療腫瘤的方式更加有效,且對正常細胞的損傷較小。目前,臨床研究已開發出多種針對氨基酸轉運體、谷氨酰胺、精氨酸等在內的氨基酸或氨基酸代謝酶的試劑,部分藥物對腫瘤細胞表現出良好的療效。然而,由于部分針對氨基酸代謝酶的天然藥物存在半衰期短、療效差與藥物抗性等問題,設計針對氨基酸代謝的有效藥物仍存在問題。值得注意的是,腫瘤細胞的發生與發展通常由多種因素相互作用所致,而氨基酸及其代謝物參與調控的腫瘤誘導因素包括腫瘤微環境中的信號分子的傳導,腫瘤代謝重編程的發生,持續增殖能力的獲得以及免疫反應的產生。因此,未來研究腫瘤中的氨基酸代謝將更應該關注氨基酸代謝的關鍵酶、氨基酸代謝的多種信號通路,及其與葡萄糖、脂質代謝的關聯,為尋找腫瘤細胞內氨基酸代謝的感應、反饋機制及藥物靶點奠定理論基礎。


